La setmana passada molts mitjans es van fer ressò que als Estats Units s’anaven a alliberar mosquits transgènics. L’experiment planteja introduir 150.000 mosquits modificats genèticament per a combatre al mosquit de la febre groga en els Keys de Florida. En realitat, no és la primera vegada que la signatura tecnològica Oxitec duu a terme en el camp un experiment d’aquest tipus, anteriorment la tècnica s’ha provat al Brasil, Panamà, Malàisia i les Illes Caiman. La notícia radica en el fet que és la primera vegada que es deixen anar mosquits modificats als Estats Units i la polèmica, que no és poca, que s’ha generat entre els ciutadans de la zona afectada.
Els dubtes i queixes dels veïns són comprensibles. Els mosquits són un tema sensible, més encara si es tracta d’un mosquit capaç de transmetre malalties com és el cas del mosquit de la febre groga. De fet s’estima que Aedes aegypti no representa més que el 4% dels mosquits dels Keys de Florida i no obstant això, és el principal responsable de les malalties transmeses per mosquits en la zona. Uns números que justifiquen l’actuació contra l’espècie, però que al mateix temps justifica el temor de la gent al saber que s’afegiran a la regió milers mosquits de l’espècie a combatre. Com pot eliminar-se una població incorporant individus? La resposta està en la genètica.
El primer és aclarir que el que s’allibera són mosquits mascle, és a dir individus que no piquen. Recordem que només les femelles s’alimenten de sang. Així doncs, els milers de mosquits deixats anar en els Keys de Florida en principi no suposen ni una molèstia ni un risc sanitari per als habitants. Però a més aquests mascles tenen un particularitat: han estat modificats. Els animals són portadors d’un gen que en passar a la seva descendència, mata a la descendència femenina en les primeres etapes larvàries, però no als descendents masculins. Els descendents masculins continuaran portant el gen dels mosquits modificats i el tornaran a transmetre a la seva descendència. La idea és que el gen va matant a les femelles generació rere generació. El procés cada serà més ràpid perquè hi haurà més mascles portadors del gen, fins que arribi un punt en què la població quedi molt reduïda. Sense tot just femelles que puguin transmetre la malaltia.
Distorsionant les lleis de l’herència mendeliana
El procés és possible mitjançant el que es denomina “genètica dirigida” (gene drive en anglès). Aquesta consisteix a introduir organismes modificats genèticament i dissenyats per a propagar una característica triada, en aquest cas un gen que mata a les femelles durant el desenvolupament. La genètica dirigida suposa distorsionar l’herència en favor del gen que ens interessa que es transmeti. Consisteix a trencar la probabilitat que una cria tingui un 50% d’heretar qualsevol gen de qualsevol dels progenitors. La genètica dirigida aconsegueix elevar la probabilitat a un 80-90%, garantint així que un nou gen introduït es propagui en la població generació rere generació fins que la majoria dels individus el posseeixen (Fig. 1).

Fig. 1. La biotecnologia de la genètica dirigida trenca les regles de l’herència mendeliana. En una situació normal, el gen introduït (en vermell) l’heretaria només el 50% de la descendència, desapareixent a poc a poc de la població si no presenta cap avantatge evolutiu, no obstant això. l’eines de la genètica dirigida aconsegueix que aquesta probabilitat d’herència aconsegueixi nivells d’un 80-90% permetent que el nou gen s’expandeixi per la població. Font: Mosquito Alert CC-BY
La idea de crear aquest “impuls genètic” per a modificar la genètica d’una població completa va sorgir fa més de mig segle per a combatre algunes plagues d’insectes, però ha estat en l’última dècada quan s’ha convertit en una realitat. Això ha estat gràcies al descobriment del CRISPR/Cas9. Una eina que ha revolucionat l’enginyeria genètica.
L’ús de CRISPR/Cas9 va néixer de l’estudi del sistema de defensa dels bacteris contra els virus (sí, la guerra contra els virus també té lloc en el món microscòpic). CRISPR és el mecanisme que permet als bacteris tallar l’ADN del virus que l’ataca i incorporar la seqüència viral al seu propi codi genètic. Aquest “retalla i enganxa” li permet als bacteris tenir una memòria molecular del virus que les ha agredit, podent identificar en el futur l’atac de manera immediata. El que els bacteris usen per a introduir corts d’ADN en genomes virals per a prevenir infeccions, ha estat usat pels científics per a tallar l’ADN de qualsevol organismes i editar els seus gens amb gran precisió. Per a això cal afegir al CRISPR/Cas9 un ARN guia (RNAg) que condueix a les tisores fins al lloc on es desitja afegir el nou gen. Si es dissenya un sistema d’autoduplicació, una vegada introduïda aquesta maquinària molecular en una cadena d’ADN s’autocopiarà en l’altre cromosoma després de la reproducció, fent que les probabilitats que el gen sigui heretat siguin pràcticament del 100% i s’expandeixi per tota la població silvestre.
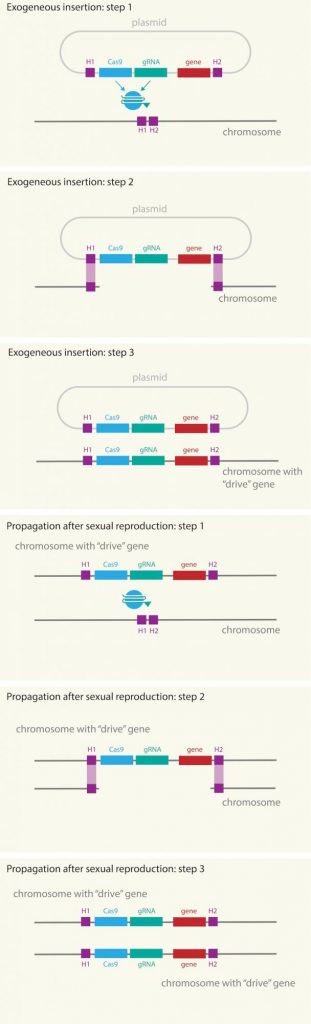
Fig. 2. Esquema de com funciona la genètica dirigida, en la qual la maquinària CRISPR/Cas9, el ARNguía (RNAg) i el gen modificat, s’introdueixen a través d’un plasmidi en el cromosoma dels mosquits mascles. Primer el RNAg identifica la posició, cas9 curta, obre la cadena d’ADN i còpia tot el paquet, inclòs el gen d’interès. Tots aquests elements es repliquen en tots els cromosomes, fins i tot després de la reproducció copiant-se del cromosoma heretat del mascle al de la femella. Font: Mosquito Alert CC-BY
Obrir la caixa de Pandora?
La metodologia pot suposar una revolució en el control dels mosquits i les seves malalties. Un sistema alternatiu als insecticides, l’ús generalitzat dels quals acaba generant resistència en les poblacions tractades. No obstant això la tècnica, com tota nova innovació, encara ha de resoldre diverses preguntes. No se sap l’estabilitat a mitjà i llarg termini que tindran els gens introduïts. En experiments previs s’han identificat mutacions en el gen però sense que afectés la seva funcionalitat, però això no garanteix que puguin aparèixer mutacions en el futur que proporcioni a aquests individus uns certs avantatges. I si intentant eliminar-los donem lloc a mosquits més resistents? Què succeeix amb la resta d’organismes? Pot el nou gen passar involuntàriament a altres espècies i afectar-les? Què succeirà en l’ecosistema si aconseguim extingir una espècie de mosquit? Florirà una altra en el seu lloc? Afectarà la biologia d’altres espècies? Les interaccions dins d’un ecosistema són múltiples i complexes, la desaparició d’una espècie pot generar una reacció en cadena que afecti a unes altres. Sabem quin és el paper ecològic dels mosquits?
La genètica dirigida és molt prometedora. Una eina que podria millorar la vida de milions de persones que viuen en regions on el dengue, la chikungunya, el Zika o la malària són malalties endèmiques. No obstant això alliberar animals modificats genèticament que poden reproduir-se sense control pot ser com obrir la caixa de Pandora: una vegada que els seus mals han sortit al món ja no es poden tornar a tancar. Per això, aquests experiments controlats són tan importants. Els resultats que s’obtinguin d’ells poden marcar el futur de la nostra històrica guerra amb els mosquits, encara que quedaran per resoldre els aspectes ètics d’aquesta nova biotecnologia.
Lecturas complementàries:
Adelman ZN, Tu Z. 2016. Control of mosquito-borne infectious diseases: sex and gene drive. Trends in Parasitology 32: 219-229
Carballar-Lejarazú R. Ogaugwu C, Tushar T, Kelsey A, Pham TB, Murphy J, Schmidt H, Lee Y, Lanzaro GC, James AA. 2020. Next-generaion gene drive for population modification of the malaria vector mosquito, Anopheles gambiae. PNAS 117: 22805-22814
Meghani Z, Boete C. 2018. Genetically engineered mosquitoes, Zika and other arboviruses, community engagement, costs, and patents: ethical issues. PLoS Neglected Tropical Diseases 12: e0006501
Scudellari M. 2019. Self-destructing mosquitoes and sterilized rodents: the promise of genes drives. Nature 571: 160-162
Waltz E. 2021. First genetically modified mosquitoes released in the United States. Nature 10.1038/d41586-021-01186-6