La semana pasada muchos medios se hicieron eco de que en Estados Unidos se iban a liberar mosquitos transgénicos. El experimento plantea introducir 150.000 mosquitos modificados genéticamente para combatir al mosquito de la fiebre amarilla en los Cayos de Florida. En realidad, no es la primera vez que la firma tecnológica Oxitec lleva a cabo en el campo un experimento de este tipo, anteriormente la técnica se ha probado en Brasil, Panamá, Malasia y las Islas Caimán. La noticia radica en que es la primera vez que se sueltan mosquitos modificados en Estados Unidos y la polémica, que no es poca, que se ha generado entre los ciudadanos de la zona afectada.
Las dudas y quejas de los vecinos son comprensibles. Los mosquitos son un tema sensible, más aún si se trata de un mosquito capaz de transmitir enfermedades como es el caso del mosquito de la fiebre amarilla. De hecho se estima que Aedes aegypti no representa más que el 4% de los mosquitos de los Cayos de Florida y sin embargo, es el principal responsable de las enfermedades transmitidas por mosquitos en la zona. Unos números que justifican la actuación contra la especie, pero que al mismo tiempo justifica el temor de la gente al saber que se añadirán a la región miles mosquitos de la especie a combatir. ¿Cómo puede eliminarse una población incorporando individuos? La respuesta está en la genética.
Lo primero es aclarar que lo que se libera son mosquitos macho, es decir individuos que no pican. Recordemos que solo las hembras se alimentan de sangre. Así pues, los miles de mosquitos soltados en los Cayos de Florida en principio no suponen ni una molestia ni un riesgo sanitario para los habitantes. Pero además estos machos tienen un particularidad: han sido modificados. Los animales son portadores de un gen que al pasar a su descendencia, mata a la descendencia femenina en las primeras etapas larvarias, pero no a los descendientes masculinos. Los descendientes masculinos seguirán portando el gen de los mosquitos modificados y lo volverán a transmitir a su descendencia. La idea es que el gen va matando a las hembras generación tras generación. El proceso cada será más rápido porque habrá más machos portadores del gen, hasta que llegue un punto en que la población quede muy reducida. Sin apenas hembras que puedan transmitir la enfermedad.
Distorsionando las leyes de la herencia mendeliana
El proceso es posible mediante lo que se denomina “genética dirigida” (gene drive en inglés). Esta consiste en introducir organismos modificados genéticamente y diseñados para propagar una característica elegida, en este caso un gen que mata a las hembras durante el desarrollo. La genética dirigida supone distorsionar la herencia en favor del gen que nos interesa que se transmita. Consiste en romper la probabilidad de que una cría tenga un 50% de heredar cualquier gen de cualquiera de los progenitores. La genética dirigida consigue elevar la probabilidad a un 80-90%, garantizando así que un nuevo gen introducido se propague en la población generación tras generación hasta que la mayoría de los individuos lo poseen (Fig. 1).

Fig. 1. La biotecnología de la genética dirigida rompe las reglas de la herencia mendeliana. En una situación normal, el gen introducido (en rojo) lo heredaría solo el 50% de la descendencia, desapareciendo poco a poco de la población si no presenta ninguna ventaja evolutiva, sin embargo. la herramientas de la genética dirigida logra que esta probabilidad de herencia alcance niveles de un 80-90% permitiendo que el nuevo gen se expanda por la población. Fuente: Mosquito Alert CC-BY
La idea de crear dicho “impulso genético” para modificar la genética de una población completa surgió hace más de medio siglo para combatir algunas plagas de insectos, pero ha sido en la última década cuando se ha convertido en una realidad. Esto ha sido gracias al descubrimiento del CRISPR/Cas9. Una herramienta que ha revolucionado la ingeniería genética.
El uso de CRISPR/Cas9 nació del estudio del sistema de defensa de las bacterias contra los virus (sí, la guerra contra los virus también tiene lugar en el mundo microscópico). CRISPR es el mecanismo que permite a las bacterias cortar el ADN del virus que lo ataca e incorporar la secuencia viral a su propio código genético. Este “corta y pega” le permite a las bacterias tener una memoria molecular del virus que las ha agredido, pudiendo identificar en el futuro el ataque de manera inmediata. Lo que las bacterias usan para introducir cortes de ADN en genomas virales para prevenir infecciones, ha sido usado por los científicos para cortar el ADN de cualquier organismos y editar sus genes con gran precisión. Para ello hay que añadir al CRISPR/Cas9 un ARN guía (RNAg) que conduce a las tijeras hasta el lugar donde se desea añadir el nuevo gen. Si se diseña un sistema de autoduplicación, una vez introducida esta maquinaria molecular en una cadena de ADN se autocopiará en el otro cromosoma tras la reproducción, haciendo que las probabilidades de que el gen sea heredado sean prácticamente del 100% y se expanda por toda la población silvestre.
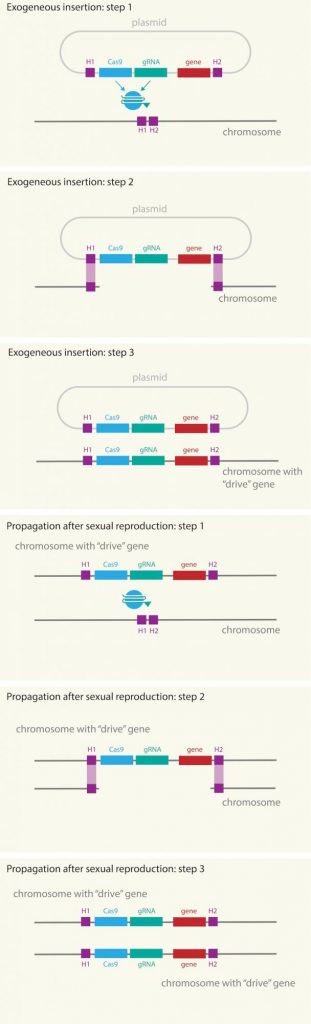
Fig. 2. Esquema de como funciona la genética dirigida, en la que la maquinaria CRISPR/Cas9, el ARNguía (RNAg) y el gen modificado, se introducen a través de un plásmido en el cromosoma de los mosquitos machos. Primero el RNAg identifica la posición, cas9 corta, abre la cadena de ADN y copia todo el paquete, incluido el gen de interés. Todos estos elementos se replican en todos los cromosomas, incluso tras la reproducción copiándose del cromosoma heredado del macho al de la hembra. Fuente: Mosquito Alert CC-BY
¿Abrir la caja de Pandora?
La metodología puede suponer una revolución en el control de los mosquitos y sus enfermedades. Un sistema alternativo a los insecticidas, cuyo uso generalizado acaba generando resistencia en las poblaciones tratadas. Sin embargo la técnica, como toda nueva innovación, aún tiene que resolver varias preguntas. No se sabe la estabilidad a medio y largo plazo que tendrán los genes introducidos. En experimentos previos se han identificado mutaciones en el gen pero sin que afectase a su funcionalidad, pero eso no garantiza que puedan aparecer mutaciones en el futuro que proporcione a esos individuos ciertas ventajas. ¿Y si intentando eliminarlos damos lugar a mosquitos más resistentes? ¿Qué sucede con el resto de organismos? ¿Puede el nuevo gen pasar involuntariamente a otras especies y afectarlas? ¿Qué sucederá en el ecosistema si logramos extinguir una especie de mosquito? ¿Florecerá otra en su lugar? ¿Afectará a la biología de otras especies? Las interacciones dentro de un ecosistema son múltiples y complejas, la desaparición de una especie puede generar una reacción en cadena que afecte a otras. ¿Sabemos cuál es el papel ecológico de los mosquitos?
La genética dirigida es muy prometedora. Una herramienta que podría mejorar la vida de millones de personas que viven en regiones donde el dengue, la chikungunya, el Zika o la malaria son enfermedades endémicas. Sin embargo liberar animales modificados genéticamente que pueden reproducirse sin control puede ser como abrir la caja de Pandora: una vez que sus males han salido al mundo ya no se pueden volver a encerrar. Por eso, estos experimentos controlados son tan importantes. Los resultados que se obtengan de ellos pueden marcar el futuro de nuestra histórica guerra con los mosquitos, aunque quedarán por resolver los aspectos éticos de esta nueva biotecnología.
Lecturas complementarias:
Adelman ZN, Tu Z. 2016. Control of mosquito-borne infectious diseases: sex and gene drive. Trends in Parasitology 32: 219-229
Carballar-Lejarazú R. Ogaugwu C, Tushar T, Kelsey A, Pham TB, Murphy J, Schmidt H, Lee Y, Lanzaro GC, James AA. 2020. Next-generaion gene drive for population modification of the malaria vector mosquito, Anopheles gambiae. PNAS 117: 22805-22814
Meghani Z, Boete C. 2018. Genetically engineered mosquitoes, Zika and other arboviruses, community engagement, costs, and patents: ethical issues. PLoS Neglected Tropical Diseases 12: e0006501
Scudellari M. 2019. Self-destructing mosquitoes and sterilized rodents: the promise of genes drives. Nature 571: 160-162
Waltz E. 2021. First genetically modified mosquitoes released in the United States. Nature 10.1038/d41586-021-01186-6