En menos de 40 años el mosquito tigre, originario del Sudeste asiático, ha logrado invadir todos los continentes excepto la Antártida. Esta capacidad de dispersión y colonización se explica por la facultad de sus huevos para soportar tanto la desecación como las bajas temperaturas. Unas características que le han permitido alcanzar regiones templadas y con ello aumentando el riesgo de transmisión de enfermedades típicamente tropicales como el dengue, el Zika o la chikungunya en estas zonas. En Croacia, Francia, España e Italia se han detectado en los últimos años brotes locales de dengue y chikungunya atribuidos a la presencia del mosquito tigre.
Para reducir tanto las molestias como el riesgo de transmisión de enfermedades, se llevan a cabo programas de vigilancia y de gestión que suelen centrarse en el control de los lugares de cría y la aplicación de productos larvicidas que impiden el desarrollo larvario. El uso de insecticidas para matar a los mosquitos adultos solo está recomendado en lugares donde hay transmisión de alguna de las enfermedades o un riesgo de transmisión muy alto. Los únicos insecticidas autorizados en Europa son a base de piretroides, una sustancia que interfiere con el sistema nervioso del mosquito. La eficacia de estos productos se está viendo comprometida por un aumento de la resistencia de los insectos a los piretroides (Fig. 1).
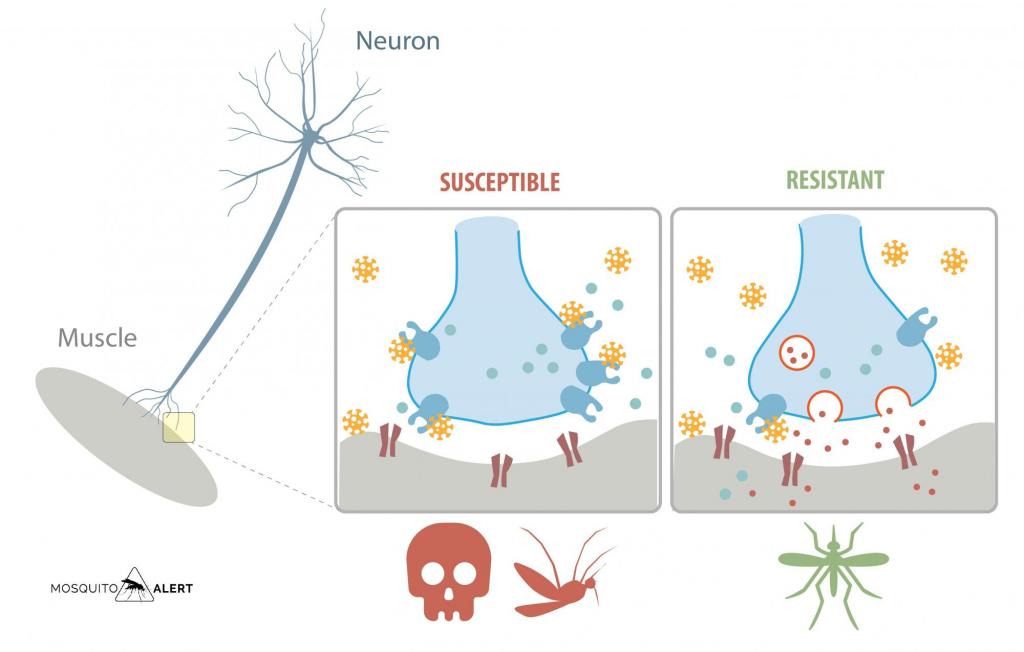
Fig. 1. Los efectos tóxicos de los piretroides (moléculas amarillas) están mediados por la prevención del cierre de los canales de sodio (canales azules) dependientes de voltaje en las membranas axonales de las neuronas de los insectos. El canal de sodio es una proteína de membrana con un interior hidrofílico. Este interior tiene una forma precisa para permitir que los iones de sodio atraviesen la membrana, ingresen al axón y propaguen un potencial de acción. Cuando la toxina mantiene los canales en su estado abierto, los nervios no pueden repolarizarse, dejando la membrana axonal permanentemente despolarizada, paralizando al organismo y ocasionando su muerte. Los mosquitos con según que mutaciones presentan menos canales de sodio, lo que hace que los piretroides (amarillo) no puedan unirse a ellos y mantener los canales permanentemente abiertos, lo que permite la liberación normal de neurotransmisores (círculos rojos y azules). Fuente: Mosquito Alert CC-BY, modificado de Kubik et al. 2021. Scientific Reports 11: 7301.
La presencia de la mutación supone una nueva amenaza para el control de enfermedades como el dengue o la chikingunya
En el caso del mosquito tigre se han detectado varias mutaciones vinculadas a una mayor resistencia a los piretroides, entre ellos los alelos: 1534C, 1534S y 1016G, siendo éste último el que confiere los niveles más altos de resistencia. Hasta la fecha, esta mutación solo se había encontrado en Italia, pero un nuevo estudio realizado en el marco del AIM-COST Action (en el cual han participado miembros de la Mosquito Alert Digital Entomology Network y de la ReNED, entre ellos Sarah Delacour Estrella, Daniel Bravo Barriga y Francisco Collantes Alcaraz) ha actualizado la presencia y distribución de esta mutación en el continente.
El análisis genético de 2.530 mosquitos tigre de 69 localidades en 19 países europeos, ha demostrado que la mutación está ampliamente distribuida por la región (ver mapa, basado en los datos originales de Pichler et al. 2o22. Parasites & Vectors 15: 280). Se ha identificado en 12 localidades de 9 de los 19 países analizados, con frecuencias que oscilan entre el 1 y el 8%. Se han identificado dos grupos: uno occidental, sobre todo en la costa de Italia, Francia y Malta, así como en una localidad de España y otra de Suiza, con presencia de la mutación 1016G; y un bloque oriental que abarca a diferentes países de los Balcanes, Turquía y Georgia. «El presente estudio representa el primer esfuerzo para mapear la mutación V1016G a escala continental en Europa» dice Daniel Bravo Barriga, de la Universidad de Extremadura, para añadir que «el mapa, que se irá actualizando con nuevos datos, supone una herramienta fácil y útil a los funcionarios de salud pública y empresas privadas involucradas en el control de mosquitos«.
Los resultados muestran que la mutación que confiere resistencia a los insecticidas de piretroides está ampliamente extendida por Europa, tanto en la zona más occidental como la más oriental, aunque las frecuencias detectadas son más bajas a las previamente documentadas en Italia donde se ha hecho un uso más prolongado de piretroides que ha acabado favoreciendo la selección de los individuos más resistentes. Los autores del estudios sugieren incorporar los análisis genéticos a los programas de vigilancia para detectar a tiempo la presencia de individuos resistentes, pues representan un sistema poderoso para detectar signos tempranos de resistencia en las poblaciones, lo cual permitiría implementar otras medidas de control que evitaran un aumento de la resistencia reduciendo así la eficacia de los insecticidas. Sarah Delacour Estrella, investigadora de Quimera Biological Systems y la Universidad de Zaragoza subraya que "los resultados son interesantes de cara a fomentar un uso responsable de los biocidas, pues un uso incorrecto puede llevar a la pérdida de herramientas que podamos emplear en caso de actuaciones de urgencias tras la aparición de brotes epidémicos de enfermedades transmitidas por mosquitos".
Referencias:
Pichler V, Caputo B, Valadas V, Micocci M, Horvath C, Virgillito C, Akiner M, Balatsos G, Bender C, Besnard G, Bravo-Barriga D, Bueno-Mari R, Collantes F, Delacour-Estrella S, Dikolli E, Falcuta E, Flacio E, García-Pérez AL, Kalan K, Kavran M, L’Ambert G, Lia RP, Marabuto E, Medialdea R, Melero-Alcibar R, Michaelakis A, Mihalca A, Mikov O, Miranda MA, Müller P, Otranto D, Pajovic I, Petric D, Rebelo MT, Robert V, Rogozi E, Tello A, Zitko T, Schaffner F, Pinto J, della Torre A. 2022. Geographic distribution of the V1016G knockdown resistance mutation in Aedes albopictus: a warning bell for Europe. Parasites & Vector 15: 280
Kubik TD. Snell TK, Saavedra-Rodriguez K, Wilusz J, Anderson JR, Lozano-fuentes S, Black IV WC, Campbell CL. 2021. Aedes aegypti miRNA-33 modulates permethrin induced toxicity by regulating VGSC transcripts. Scientific Reports 11: 7301
Kasai S, Caputo B, Tsunoda T, Chi cuong T, Maekawa Y, Lam-Phua SG, Pichler V, Itokawa K, Murota K, Komagata O, Yoshida C, Chung HH, Bellini R, Tsuda Y, Teng HJ, Filho JLL, Alves LC, Ching Ng L, Minakawa N, Thi Yen N, Vu Pong T, Sawabe K, Tomita T. 2019. First detection of a Vssc allele V1016G conferring a high level of insecticide in Aedes albopictus collected from Europe (Italy) and Asia (Vietnam), 2016: a new emerging threat to controlling arboviral diseases. Eurosurveillance 24: 5